|
Accueil Introduction Conclusion |
||
|
Partie I Partie II Partie III |
||
 Les tensio-actifs à l'origine des bulles
Les tensio-actifs à l'origine des bulles

1) Composition microscopique d'une bulle A) Composition d'une bulle de savon * Les molécules amphiphiles On peut faire des bulles de savon juste en brassant de l'eau et de l'air. Regardez donc dans un torrent de montagne, au pied d'une cascade ou encore lorsque vous remplissez un verre d'eau à forte pression ! Mais il ne suffit pas de les former : il faut qu'elles durent. C'est pour cela que l'on utilise du savon. Ce dernier est composé de molécules bien particulières, les tensio-actifs, formées de deux parties : - Une tête polaire soluble dans l'eau, que l'on nomme "d'hydrophile ". - Une chaîne carbonée, de 10 à 20 atomes de carbone qui sont repoussés par l'eau, qualifiée " d'hydrophobe ". Au final, ces molécules aiment à la fois l'eau et la repoussent. On les a baptisées " molécules amphiphiles ". Elles permettent aux bulles de durer. Nous savons qu'il est impossible de faire des bulles avec de l'eau pure, c'est pourquoi il est nécessaire d'ajouter du liquide vaisselle ou du savon. En effet, ces derniers, comportant des tensio-actifs, diminuent la tension superficielle du liquide, car contrairement aux molécules d'eau, elles sont attirées par la surface et tentent de diminuer cette tension en créant une interface particulière entre l'eau et l'air : ces molécules bipolaires ont leurs extrémités chargées de manière opposée.
De plus, on sait que l'eau est une molécule polaire. Dans un liquide aqueux, les tensio-actifs vont se placer à la surface. Une extrémité est repoussé par l'eau et attirée par l'air à la surface. Cela entraîne la diminution de la tension superficielle de la bulle. Comme la tête polaire est attirée par l'eau et la queue par l'air, ces molécules sont appelées " surfactants " puisqu'elles se concentrent à la surface du liquide. Leur disposition dans un liquide peut être schématisé de la manière suivante :
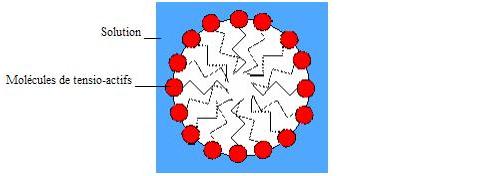
Cependant certaines molécules ne peuvent être à la surface par manque de place. Elles forment alors avec d'autres tensio-actifs des micelles (molécules se rejoignent par leur queue hydrophobe pour ne présenter que les têtes hydrophiles vers l'eau).
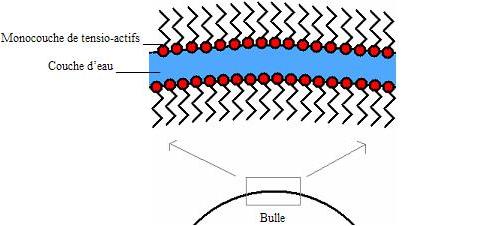
* Comment se disposent les molécules amphiphiles dans une bulle de savon ? Une bulle de savon n'est rien d'autre qu'une fine membrane de mélange savonneux entourant un certain volume d'air. Elle se compose donc par une mince couche d'eau maintenue entre deux monocouches de tensio-actifs, puisqu'on a vu précédemment que ces molécules étaient amphiphiles. En réalité, ces molécules sont près de 1000 fois plus petites que l'épaisseur de la paroi de la bulle (quelques nanomètres par rapport à quelques microns). Voici une schématisation de la disposition des molécules pour créer une bulle de savon.
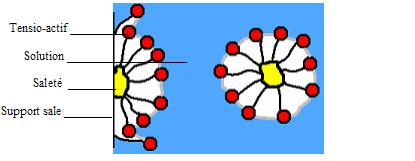
En effet, dans un film de savon, il y a un film d'eau couvert de part et d'autre d'une couche simple de tensio-actifs. Cela se déduit du fait que les têtes hydrophiles des ces molécules soient dirigées vers l'eau alors que les queues hydrophobes sont orientées vers l'air. B) Comment se forme une bulle et pourquoi est-elle ronde? * Formation d'une bulle Donc dans un produit à bulles, on a des tensio-actifs. Or, amener une molécule à la surface du liquide coûte une certaine énergie : aussi plus la taille de la surface est petite, moins l'on a besoin de molécules en surface et plus le système sera favorisé. Ce phénomène apparaît dès que l'on a un liquide avec une surface élastique qui veut une tension de surface minimale. Cependant, on ne pourra jamais obtenir une bulle avec de l'eau pure : on ne peut y parvenir que si l'on diminue la tension superficielle du liquide. C'est dans ce but que l'on ajoute du savon. En effet, lorsque l'on souhaite former une bulle, on doit étirer sa surface (comme un ballon de baudruche s'étire lorsqu'on le gonfle) et donc l'agrandir : on doit alors avoir un nombre plus important de molécules sur l'interface ce qui coûte d'avantage d'énergie. Ainsi, au fur et à mesure que l'on souffle pour agrandir la bulle, la surface de cette dernière s'étire. * Pourquoi une bulle est-elle ronde ? En raison de la tension superficielle, les films d'eau savonneuse, dotés d'une certaine élasticité, doivent utiliser de l'énergie pour s'étirer, comme on le fait sans s'en rendre compte lorsque l'on produit une bulle. Ce phénomène peut être, dans une certaine mesure, comparé au gonflage d'un ballon de baudruche, à ceci près que les films de savon sont constitués de liquides et que l'énergie mise en jeu pour produire une bulle est beaucoup moins importante. La pression du gaz contenu dans une bulle est légèrement supérieure à la pression atmosphérique environnante. Cela suffit à gonfler la bulle. Plus l'aire d'un film liquide est importante, plus son énergie potentielle est élevée. Or tout système matériel atteint un équilibre lorsque son énergie potentielle est minimale. Une bulle de savon tend donc naturellement à prendre la forme qui lui permet d'enfermer un volume d'air donné dans une surface minimale. Il s'agit après constatations de la sphère. Mais constater n'est pas démontrer et les mathématiciens, Archimède en tête, y ont longtemps réfléchi. Il a fallut attendre 1882 pour que le mathématicien allemand Hermann Amandus Schwarz prouve que parmi toutes le surfaces enfermant un volume donné, la sphère est bel et bien celle qui présente l'aire minimale. Comme nous l'avons vu, les molécules s'attirent entre elles à l'intérieur d'un liquide ; l'état d'équilibre, autrement dit l'état le plus stable en l'absence de perturbations, est donc toujours celui où la surface de contact entre le liquide et l'aire est la plus petite. Par conséquent, pour le liquide savonneux, la forme la plus stable correspond à une sphère. Cette forme est un néanmoins système hors équilibre et donc relativement instable (à la moindre fuite, la bulle se déchire et redevient une simple goutte de liquide). Ainsi la sphère permet une économie d'énergie. 2) la spécificité du savon A) Pourquoi faut-il du savon pour former des bulles ? Dans l'eau, il y a une attraction forte entre les molécules qui la composent. En effet, l'eau est constituée des molécules H2O qui possèdent un pôle assez électronégatif (atome d'oxygène) et deux pôles peu électronégatifs (atomes d'hydrogène). Ces deux types de pôles s'attirent donc pour former des liaisons intermoléculaires qui assurent la cohésion du liquide à l'échelle microscopique. Donc l'eau " cherche " à former des gouttes. Si on essaie de l'étaler, de la mettre en film fin, elle reforme immédiatement des gouttes. Autrement dit, elle essaie d'avoir une surface minimale au contact de l'air. Si on ajoute du savon dans l'eau, ces forcent existent toujours mais diminuent. On pourra étaler plus facilement un film d'eau sans qu'il se casse. En effet, le savon et le liquide vaisselle sont composés entre autres de tensio-actifs qui vont diminuer la tension superficielle du liquide. B) Pourquoi le savon lave-t-il ? Comme on a vu précédemment, les molécules de tensio-actifs possèdent une partie hydrophile et une partie hydrophobe. On peut alors dire qu'une extrémité de ces molécules est soluble dans l'eau et l'autre dans l'huile. En réduisant la tension superficielle de l'eau, les surfactants permettent une meilleure pénétration de l'eau dans les surfaces sales : les molécules de tensio-actifs forment des micelles sphériques qui emprisonnent les salissures huileuses et les maintiennent en suspension dans l'eau.
C'est cette différence entre la tête et la queue qui confère au tensio-actif la propriété de s'absorber à une interface donnée pour diminuer la tension superficielle. Par exemple, les molécules amphiphiles d'un détergent sont introduites dans un mélange eau/huile. Elles vont se placer de telle sorte que les queues hydrophobes seront repoussées par l'eau alors que les têtes en seront attirées. Au repos, ces liquides sont séparés par densité. L'interface est plane et les tensio-actifs s'y fixent, têtes vers l'eau. Si l'on agite l'ensemble et que la concentration en détergeant est suffisante (concentration micellaire critique), il y a formation de gouttes d'huile entourées de tensio-actifs dans l'eau. De façon générale, l'agent tensio-actif se fixe à l'interface du côté du liquide qui " mouille " le mieux. De plus, s'il s'agit d'un savon de soude (un savon est un sel de sodium d'acides gras obtenus par action de la soude sur le gras), la tête est ionisable (l'ion alcalin passe en solution) et ainsi les gouttes chargées négativement se repoussent, ce qui évite toute coagulation. Un corps tensio-actifs peut également conférer à un liquide un pouvoir mouillant vis-à-vis du solide s'il peut s'y lier. C'est ainsi qu'un détergeant, dont la queue hydrophobe peut adhérer aux tissus, va également se fixer aux particules de graisse déposées sur ceux-ci. Les têtes hydrophiles tendent à se repousser et ces particules de graisse peuvent se détacher des tissus : c'est le principe des lessives. Remarques : - En modifiant la nature et la taille de la tête ou de la queue des molécules, il peut se produire une inversion de l'émulsion. Par exemple, les forces agissant sur les queues peuvent tendre à déformer l'interface jusqu'à la faire se " retourner ", on obtient alors des gouttes d'eau dans l'eau. - La quantité de tensio-actifs étant plus faible dans le savon que dans le liquide vaisselle, c'est ce dernier que l'on utilisera pour la réalisation de belles bulles de savon expérimentalement. |
||